基于肿瘤组织钙化的新型饥饿疗法为实现高抗肿瘤效率同时避免毒性药物引入吸引了越来越多的关注。 该策略通常利用钙螯合剂收集肿瘤组织中的Ca2+,通过生理性钙化在肿瘤细胞表面形成钙化层,阻断营养物质传输,抑制肿瘤细胞的生长。然而,肿瘤组织内Ca2+浓度有限并且生理性钙化过程缓慢,导致治疗效率相对较低。虽然可以额外增加Ca2+浓度来增强钙化,但过量的钙可能导致高钙血症。此外,Ca2+和螯合剂的广泛分布也可能导致在各种健康组织的随机钙化,从而扰乱其功能。因此,肿瘤饥饿治疗需要有效、精确的钙化。鉴于线粒体是细胞物质和能量代谢的重要工厂,具有丰富的Ca2+,线粒体有望成为钙化以实现肿瘤饥饿治疗的理想场所。
针对上述问题,西安交通大学化工学院陈鑫教授团队与西安交通大学药学院张彦民教授团队构建了一种唾液酸(SA)、叶酸(FA)和三苯基膦(TPP)共修饰的金纳米颗粒(SFT-Au),其利用线粒体中丰富的钙,以及SFT-Au的钙螯合和钙依赖光热特性,实现肿瘤线粒体的精确快速钙化,有效治疗恶性肿瘤。在治疗过程中,SFT-Au首先通过FA和TPP的逐步靶向过程在肿瘤线粒体中积累。之后,SA片段进一步与肿瘤线粒体中过表达的Ca2+结合,诱导SFT-Au聚集。SFT-Au不仅聚集Ca2+启动线粒体钙化,而且在808 nm照射下原位生成光热剂进行光热转化,促进线粒体钙化。从而有效抑制肿瘤细胞的能量代谢,进行饥饿治疗,并对肿瘤细胞进行持续的光热损伤,提高治疗效率(图1)。体外和体内实验结果表明,Ca2+依赖性光热疗法和光热转化促进线粒体钙化,显著抑制肿瘤生长,同时避免了意想不到的副作用。
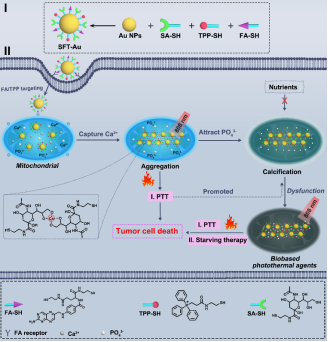
图1. SFT-Au的结构及功能示意图
相关成果以《多功能金纳米粒子通过生理依赖光热转换促进线粒体钙化用于精确饥饿治疗实现有效肿瘤治疗》(Precise starving therapy via physiologically dependent photothermal conversion promoted mitochondrial calcification based on multi-functional gold nanoparticles for effective tumor treatment)为题发表在《先进功能材料》 (Advanced Functional Materials, 2023, 2303596,影响因子19.924)上。该研究工作由西安交通大学化工学院陈鑫教授团队和西安交通大学药学院张彦民教授团队合作完成,化工学院博士生常小卫、药学院博士生唐晓煜为该文章共同第一作者,陈鑫教授与张彦民教授为共同通讯作者。该论文得到了国家高层次人才特殊支持计划、国家自然科学基金、陕西省自然科学基金、西安交通大学“青年拔尖人才支持计划”等项目的大力支持。同时感谢西安交通大学大型仪器设备共享实验中心在分析测试方面的支持。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202303596


