MiR-21/miR-155等致癌性miRNAs在多种恶性肿瘤中均呈现显著高表达,与肿瘤的增殖、分化和迁移密切相关。研究证明,降低肿瘤细胞内的致癌性miRNAs水平可有效抑制其增殖和迁移。因此,一系列能够捕获不同致癌性miRNAs的纳米材料相继被开发出来,并通过抑制相应miRNAs在一定程度上实现了对结肠癌、乳腺癌、肝癌等恶性肿瘤的治疗。然而,其推广应用仍极大受限于复杂生理环境导致的脱靶效应及治疗效率低下等问题。虽然有报道指出利用光热纳米材料/纳米药物载体等功能性成分,将抑制致癌性miRNA技术与光热治疗/化疗相结合,可通过协同作用提高治疗效率。但这些疗法往往在发挥作用时存在一定的时间和空间差异,无法高效协同。此外,纳米粒子的低胞内滞留性导致的miRNAs捕获效率不足、传统光热治疗/化疗的无选择性导致的毒副作用等缺陷均制约了联合治疗策略的临床应用。
为解决上述问题,西安交通大学化工学院陈鑫教授团队与西安交通大学药学院张彦民教授团队利用两种能与致癌性miRNAs互补配对的反义寡核苷酸修饰纳米金粒子,并进一步将抗肿瘤药物阿霉素通过杂交作用连接到反义核苷酸链上,构建了两种球形核酸(SNA1和SNA2/DOX)。利用反义寡核苷酸外壳,球形核酸能够捕获肿瘤细胞中过表达miR-21和miR-155,并有效抑制两种致癌miRNAs在肿瘤细胞中的表达,从而操纵遗传环境进行基因治疗。miR-21在被捕获的同时能够诱导两种反义核苷酸的交联,导致球形核酸的聚集。这一过程不仅能在细胞内原位产生光热试剂(聚集态纳米金)实现精准光热治疗,而且由于聚集后SNAs尺寸的显著增加,其在肿瘤细胞中的滞留时间被延长,有效提高了基因治疗与光热治疗的周期和效率。此外,miR-155在被捕获的同时能够触发阿霉素的释放,进而提供具有高度肿瘤选择性的精准化疗(图1)。体内和体外实验结果表明,这种由致癌性miRNAs一体触发的基因治疗、光热治疗、化疗联合策略不仅能够有效抑制肿瘤的生长与迁移,而且具有毒副作用小的特点,有望在肿瘤治疗中得到更广泛的应用。
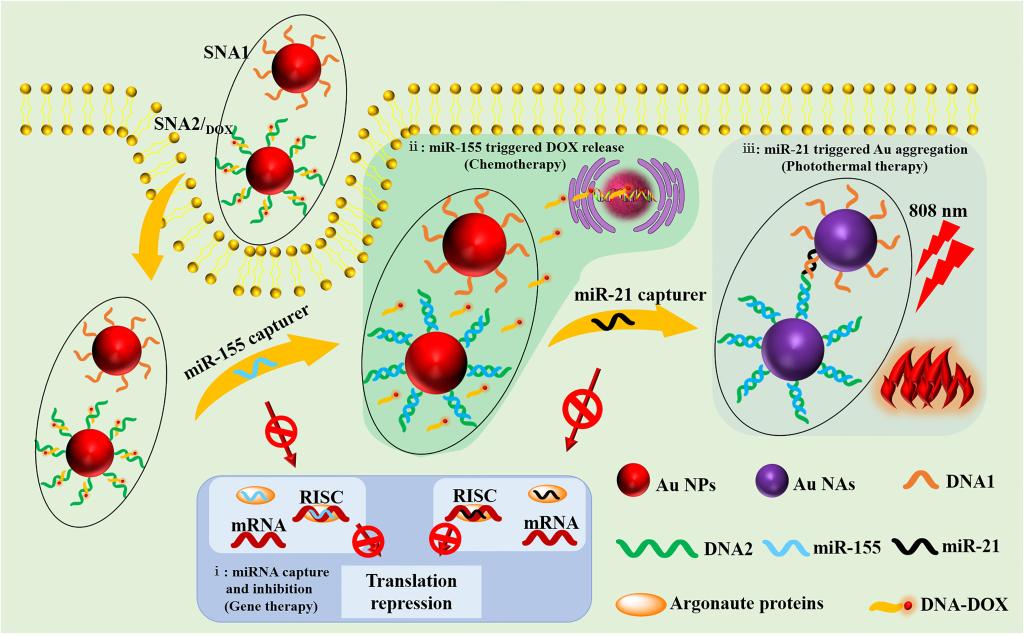
图1,球形核酸的结构及治疗机制示意图。
相关成果以《具有致癌核酸依赖活性的智能纳米金粒子用于调控肿瘤微环境实现联合治疗》(Intelligent Gold Nanoparticles with Oncogenic MicroRNA-dependent Activities to Manipulate Tumorigenic Environments for Synergistic Tumor Therapy)为题发表在《先进材料》(Advanced Materials,2022, 2110219,影响因子30.849)上。该研究工作由西安交通大学化工学院陈鑫教授团队和西安交通大学药学院张彦民教授团队合作完成,西安交通大学化工学院王向东博士、西安交通大学药学院杨天枫博士为该文章共同第一作者,陈鑫教授与张彦民教授为共同通讯作者。该论文得到了国家高层次人才特殊支持计划、国家自然科学基金、陕西省自然科学基金、西安交通大学“青年拔尖人才支持计划”等项目的支持。同时感谢西安交通大学大型仪器设备共享实验中心在分析测试方面的支持。
文章链接:https://doi.org/10.1002/adma.202110219


